感谢我和团队的翻译《shrimpbook》。
译文:对虾外壳:角质层与蜕壳周期
原文来自<ShrimpBook>原作者MathiasCorteel,HansJ.Nauwynck
全文人工翻译,相对理论的知识,避免枯燥,先上张读书笔记-两张图看懂全文。

像其他节肢动物一样,对虾体表也具有一套非常有效的覆盖物,该覆盖物具有皮肤屏障和骨骼双重作用,主要由外皮上皮细胞组成,通常该外骨骼也称之为角质层。对于这层覆盖物来说,将其理解为对虾的动态器官是十分恰当且有必要的,特别是对于生长中的动物来说,外骨骼与周期性的蜕壳密切相关。为保证正常的生长,新的角质层一般“贮存”在旧角质层之下,一旦旧的褪去,新的柔软角质层便伸展膨胀,动物体积也随之增长。鉴于以上原因,对虾大多生理机能都是伴随着蜕壳节奏的不同而发生变化,它会在特定阶段蓄积能量而用于快速生长。
目前关于十足类甲壳动物角质层的理解主要来源于鳌虾下目和短尾下目,针对对虾深入研究是缺乏的,例如对虾角质层形态和组成方面并无详细研究数据。因此,以下所述大多数内容是适用于所有甲壳动物的,针对对虾的研究成果我们会给出明确说明。
形态学
甲壳动物外骨骼属复杂的生物复合材料,主要由多聚糖、几丁质、矿物质和一些脂肪组成,关于甲壳动物外表覆盖物形态和生化组成的研究参见Compère等人综述(2004),Fabritius等(2008)以大西洋龙虾(Homarusamericanus)为例阐述了节肢动物角质层分级组成结构。
生物高聚物几丁质是外骨骼主要组成成分,它像钢筋混凝土中的钢筋一样为角质层提供抵抗张力的特性,几丁质基本单元是单糖N-乙酰-D-葡萄糖胺和D-葡萄糖胺,这些基本单元依靠“聚合剂”β-1,4-葡聚糖黏合成狭长的线性几丁质。在节肢动物中,几丁质是以反平行的方式排列:α-结晶形状排列,18-25各几丁质聚合链以直径2-5nm的晶体为中心,这种几丁质晶体核心构成中央轴,类似外套的蛋白质亚单元围绕的中央轴周围,这种几丁质-蛋白质复合物构成了7.25nm宽,0.3μm长的微纤维。考虑到几丁质和蛋白质最小组成单元大小,上述微纤维称为纳米纤维更符合实际。
蛋白质像混凝土一样围绕在几丁质绳和纳米纤维之间,这为角质层提供了不可渗透的特性,同时也增强了纳米纤维抵抗机械挤压的能力,上述蛋白组成和水分子多少都取决于角质层的机械特性(Skinner,1992;Andersen,1999)。一般蛋白组成包含两类蛋白:分别是以共价键和非共价键形式与几丁质或角质层其他成分结合的蛋白,蛋白质之间和蛋白质与几丁质之间的共价结合可以使角质层变得坚硬,这一过程主要是由酚氧化酶催化的,它可以将苯酚分子转化为可反应的醌类。分子通过共价键结合可以形成网桥,后者为角质层提供了深褐色或光滑的特性,这样蛋白质就不会溶解到水中。非共价键结合蛋白属自由蛋白,它只能与角质层其他成分以静电或水和键形式结合,这些蛋白均可以很容易地被水溶性缓冲液提取。在甲壳动物中,蜕壳之后角质层外部及其真皮层均变得光滑。
与其他研究深入的短尾亚目甲壳动物相比,对虾角质层干重中无机矿物质占到了30-50%,这使得矿化作用在针对对虾角质层操作时作用不大。对虾角质层矿物盐主要是钙、镁和碳酸锶,上述物质在自然条件下主要以晶体方解石形式存在,显然,角质层的矿化增加的对虾外壳的硬度。
电子显微镜分析表明几丁质-蛋白质微纤维成打成束组成粗纤维,后者直径可以达到100nm,角质层位置和功能的不同导致粗纤维排列也是不同的,因为后者很大程度上决定了角质层的最终机械特性。在大多数角质层中,粗纤维是众多水平面层面组成的,水平面与角质层表面平行;在每一水平平面中,粗纤维沿着长轴贮存,每一长轴都平行于其他水平片段,不同片段的夹角会有一定度数变化,但角质层整体是一个螺旋形,类似夹板的扭曲结构,由不同水平分布的粗纤维叠加形成。从外表上看,垂直层面角质层类似晶片的结构是显而易见的,侧面看还具有抛物线特征。两层相同方向的粗纤维之间的距离由薄片填充,在最外层粗纤维与其他层的纤维可能具有180°的夹角。
光学纤维镜观察发现完整的对虾角质层分为四层,从外到依次为:上表皮、外表皮、内表皮和膜层,上表皮和和外表皮形成于蜕壳前期,内表皮和膜层形成于蜕壳后期,外表皮和内表皮中可以清晰地看到纤维小板。上表皮层在组成和结构均和其他层不同,该层非常薄,富含脂质、蛋白质和矿物质,但是不含几丁质,它是机体抵抗外界因素的第一道屏障,主要参与机体渗透压调节。外表层在蜕壳之前已经形成,蜕壳之后很短时间开始矿化,颜色变深,该层是整个外骨骼的主要支撑层。内表层与外表层之间具有明显区别度,前者富含钙,它可以很好的为外表层起支撑作用。在对虾中,外表层较内表层具有更多的纤维小板,纤维小板之间的堆叠高度也要大于内表层,这点在蟹和龙虾中是反过来的。膜层位于上皮细胞之上,是内表皮层分泌形成的最后一部分,该层一般不含矿物质,属无钙化层,含有的纤维小板也较薄,这些结构在蜕壳过程汇总具有重要的功能。
上皮细胞层位于角质层最底部,主要由单层假复层上皮细胞组成,主要分泌产生整个外骨骼,包含许多精细的结构。靠近细胞层基部存在着星形色素细胞,此类细胞细胞质中色素可以视情况发生分布的改变,进而影响对虾体色(Noël,1994)。上皮细胞层还存在着其他类型细胞,如毛源性细胞,它可以释放感觉刚毛;皮肤腺细胞,它可以通过角质层中的导管存在和释放外分性物质;免疫佐细胞虽然主要还没有研究透彻,但其功能被认为和昆虫中的绛色细胞类似,主要参与角质层物质的合成(Locke,1994)。
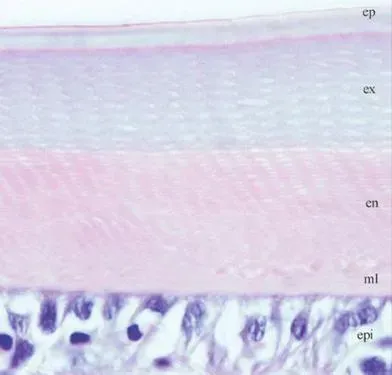
图115g重凡纳滨对虾角质层和腹足上皮细胞光学纤维图片(苏木精-曙红染色)。
ep:上表皮;ex:外表皮;en:内表皮;ml:膜层;epi:上皮细胞;ct:结缔组织
蜕壳周期:覆盖物形态和生理的周期性变化
甲壳动物蜕壳过程通常被描述为蜕壳周期,一般将旧壳蜕去到下一次蜕壳分为三个主要阶段,按时间先后依次为:蜕壳后期、蜕壳间期和蜕壳前期,第一个针对甲壳动物蜕壳研究的学者采用字母对各个阶段进行了标识,分别为A为蜕壳后期初、B为蜕壳后期末、C为蜕壳间期、D为蜕壳前期(Drach,1999)。研究初期,各个阶段的区分主要是基于骨骼和相应组织的硬度,随着附肢显微镜检技术的发展,利用刚毛形态差异即可清晰直观的区分各个蜕壳阶段(Stevenson,1972;Aiken,1973;Lyle,1983;Musgrove,2000;Gorokhova,2002)。
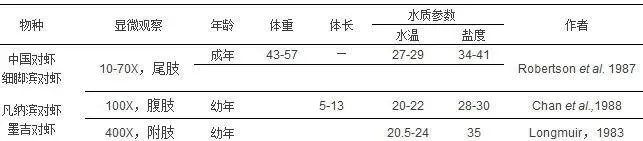
不同学者采用不同的评价标准对许多对虾属种类进行了蜕壳周期的研究,这些物种包括桃红对虾(Penaeusduorarum)、墨吉对虾(Penaeusmerguiensis)、中国对虾(Penaeussetiferus)、细脚滨对虾(Penaeusstylirostris)、凡纳滨对虾(Penaeusvannamei)和斑节对虾(Penaeusmonodon)。目前,用于评判对虾蜕壳阶段的关键指标还是上皮细胞和刚毛的形态特征,包括色素沉淀程度、新刚毛的形成、刚毛内基质、刚毛腔内空腔的存在以及所谓的刚毛器官的形成(节瘤存在)。
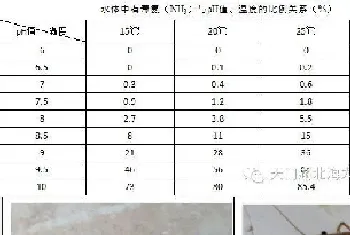
表1.关于对虾蜕壳各阶段特征的研究
接下来我们将结合已有研究和我们自己的研究对对虾蜕壳周期各阶段进行阐述。与鳌虾科和短尾下目甲壳动物相比,对虾的蜕壳周期一般短于前者,这使我们可以用有限的数字标识主要蜕壳阶段。蜕壳前期,对虾覆盖物形态和生理变化已经得到了很好的描述,但是不同的学者采用各主要阶段行了了细分,并采用不同的子阶段进行了标识,这些研究表3和图2中均有阐述(Drach,1939;Skinner,1985;Compèreetal.,2004)。
表2对虾蜕壳各主要阶段特征分析

表3凡纳滨对虾和斑节对虾蜕壳主要阶段特征详解(根据Corteeletal.文章整理)

蜕皮后期
蜕壳后期初“A”(~A1,A2)
对虾蜕壳之后身体会吸收水分使其角质层膨胀,这个阶段是生长、角质层更新、四肢修复的唯一关键时间,新形成的角质层只包括上皮层和外皮层,因为它们在蜕壳前已经分泌形成了,覆盖物的其他层结构还未硬化和矿化,因此此时的虾壳显得软、易弯和易碎。
该阶段上皮细胞通过孔道延伸到角质层中,与其紧密接触,前者会继续分泌物质到角质层以形成内表皮。该过程发展到最后,上皮层会从角质层脱落,并且刚毛腔的上皮层基质也会消失。
对虾角质层状态对对虾行为具有重要的影响,蜕壳A期时对虾步足活动不便,它们会将时间基本用于在水体中游泳,这过程也不摄食也无法抵抗同类的攻击蚕食。
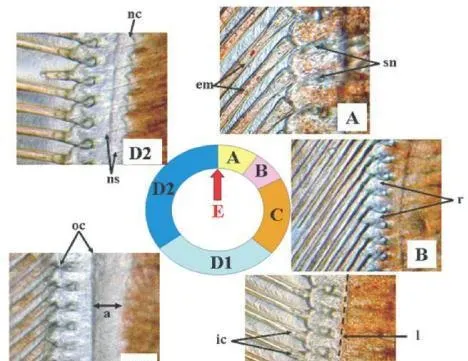
图2不同蜕壳阶段凡纳滨对虾尾肢末梢显微图片,图片以蜕壳先后顺序顺时针排列。
A:蜕壳后期初,刚毛节瘤(sn)形成,刚毛腔内开始出现上皮层基质(放大倍数200X);
B:蜕壳后期末,上皮层从刚毛处开始回缩(放大倍数100X);
C:蜕壳间期,上皮层线性排列在刚毛节瘤基部,刚毛基部开始出现小内腔(放大倍数100X);
D1:蜕壳前期初,旧角质层(oc)脱落导致其与上皮层之间空隙增大(放大倍数100X);
D2:蜕壳前期末,上皮层形成新的折叠角质层(nc)和新刚毛(ns)(放大倍数100X);
E:蜕壳期,旧壳脱落。
蜕壳后期末“B”(~B1,B2,B3,B4)
蜕壳进入B期后,上皮层和外皮层变硬,颜色也加深,整个外壳也随之硬化和变深。内皮层也开始分泌形成,外皮层和内皮层矿化也在此时发生,上皮细胞开始变小并且夹杂在内皮层中。
与此同时,之前吸收的水分也逐渐被组织所取代,这一过程直到下一蜕壳阶段开始时结束。外壳已经硬化,对虾可以利用步足行动和摄食,之前所蜕之壳是其摄食的重要食物之一。
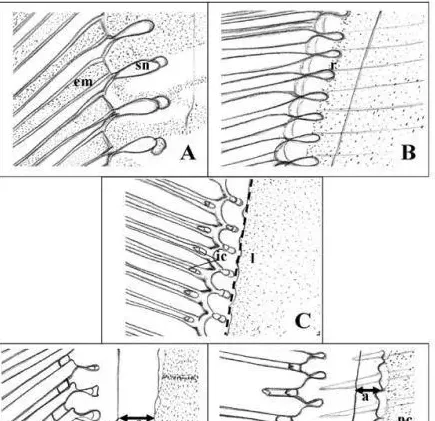
图3主要蜕壳阶段对虾尾肢末稍刚毛和上皮组织变化情况示意图。
A:蜕壳后期初,刚毛节瘤(sn)形成,刚毛腔内开始出现上皮层基质(em);
B:蜕壳后期末,上皮层开始从刚毛处回缩(r);
C:蜕壳期,上皮层线性(l)排列在刚毛节瘤基部,刚毛基部内腔(ic)清晰可见;
D1,蜕壳前期初,旧壳脱落(a)导致其与上皮层之间出现空隙;
D2,蜕壳前期末,上皮层开始形成新角质层(nc)和新刚毛(ns)。
蜕皮间期
蜕皮间期“C”(~C4)
通常认为蜕壳间期是对虾蜕壳的休息期,该阶段角质层完全形成,上皮细胞活动能力下降,形状变类似骰子的立方形。该阶段从生理角度考虑,对虾会集中经历蓄积能量,如糖原、脂质、钙等,主要蓄积在肝胰脏和肌肉中。
蜕皮前期
蜕壳前期初“D1”(~D0,D1’,D1’’,D1’’’)
促进对虾新角质层形成的荷尔蒙的分泌意味着蜕壳前期的开始,可观察到的特征是上皮细胞开始延伸变长,衍化为具有很强机械运动能力的分泌细胞,同时,细胞核分裂能力也显著增强且一直持续到蜕壳期。许多酶原(几丁质酶和蛋白酶)被分泌到膜层,要在旧壳完全褪去之前分解吸收部分旧角质层,并将其凝胶化。在D1期,通过倒置电子显微镜首先看到的新角质层形成的主要变化发生在细胞顶端膜位置,小斑块出现在顶端膜位置后不久变聚集合并,最终形成新的上皮层。蜕皮过程是从上皮层和旧角质层之间的蜕壳缝隙开始的。
该阶段,肝胰脏和肌肉代谢能力用以为新角质层的形成提供能量。
蜕壳前期末“D2”(~D2,D3,D4)
随着体积和活力的增加,上皮细胞进入D2期后开始分泌形成外表层,外表层位于上表层之下,短链低聚型几丁质和表皮蛋白以几丁质蛋白形式被合成分泌,几丁质微纤维在几丁质合成酶的催化下合,然后纤维被转移到上皮细胞外表层区域,这一些列动作会消耗肝胰脏和肌肉积累的能量,但是在蟹类等甲壳动物中并没有发现为此而过度消耗能量的现象(Csearetal.,2006)。
在该阶段,旧角质层的降解达到最大程度,相关酶在蜕壳前期开始的时候已经被分泌到膜层和内皮层靠近基部的位置,蜕壳前期初形成的蜕壳裂缝充满了蜕皮液。从此刻开始,在新角质层变得不能渗透之前,机体开始对葡萄糖胺、钙和氨基酸进行再吸收。
旧角质层的变薄给了对虾特定破壳位置,即蜕皮线,在对虾中蜕皮线位于头胸甲处,纵向步足处延伸,在蜕壳期对虾可以轻松的从旧壳逃离。
由于旧角质层变弱和新旧两层角质层的存在,对虾在这个阶段是不摄食的,这种情况一致持续到蜕壳后期末(B期),在此期间对虾的代谢完全靠之前贮存的营养物质支撑。
蜕皮期
“E”期
该期对虾会进行一系列肌肉收缩行为以脱去旧的外骨骼,头胸甲处及其与第一腹节之间位置都会发生显著性膨胀,此处像一个“舱口”一样,对虾会该处开始蜕去旧壳。
蜕壳周期的激素调控
像所有甲壳动物一样,对虾蜕壳也主要受以下四种内分泌激素调节:多肽类激素、类固醇激素、萜类激素和生物胺,整个蜕壳过程主要受多肽类的蜕皮抑制激素和类固醇类的蜕皮激素调控,这类激素作用是相对立的。
蜕皮抑制激素(MIH)由位于眼柄X器官的内分泌细胞产生,蜕皮激素主要由Y器官产生,后者位于臂前波斯管上皮细胞产生。
血淋巴中的蜕皮抑制激素含量维持在高位时,对虾蜕壳过程基本停止并长期停留在蜕壳间期,蜕壳抑制激素减少的同时血淋巴中的蜕皮激素含量开始增加,Blais(1994)研究发现凡纳滨对虾Y器官分泌的主要蜕皮激素为3-去氢蜕皮松(3DE),它可以在上皮细胞中代谢演变为20-羟基蜕皮激素,后者可以刺激细胞为蜕皮做准备。蜕壳前期初结束时,血淋巴中蜕皮激素含量会维持在高位,进入蜕壳前后末时由于上皮细胞分泌功能的增强,蜕壳激素含量达到最大值,随之蜕壳行为的推进,蜕皮激素会在蜕壳前期结束时出现显著下降,之后各个蜕皮阶段期含量一直维持在较低水平。
甲壳动物糖激素(CHH)最初被归为调节碳水化合物代谢的核心激素,但事实上,该激素和蜕皮抑制激素(MIH)、性腺抑制激素(GIH)和下颌器官抑制激素(MOIH)一样,同属于神经肽价家族成员。上述激素一起协作调节甲壳动物蜕壳、糖代谢、繁殖和渗透压调节等生理反应,甲壳动物的窦腺复合体也能分泌糖代谢激素(CHH),后者通过影响MIH间接对对虾蜕壳激素的分泌产生抑制作用。
众所周知,另一种物质——倍半萜大甲基法尼酯——在甲壳动物蜕壳调控中也起着重要作用。在蟹类和龙虾的研究中,许多多功能单分子物质的作用已经被研究的很清晰,但这些物质在对虾蜕壳和性腺发育过程中的作用最近才开始着手研究,例如有一种与昆虫保幼激素相关的物质最近研究发现在对虾下颌器官中也能产生。除此之外,针对MOIH的研究发现,该激素主要在蜕壳前期分泌,具有促进固醇类激素分泌功能,但是MIH可以抑制其的分泌。
除此之外还有两种神经激素也必须加以说明,一种是甲壳动物心肌活动蛋白(CCAP),虽然已经被很多学者研究,但其在甲壳动物蜕皮过程中的作用还不是很清楚;另外一种是粘液素,该物质在调节昆虫角质层sclerotisationprocess中作用已经很好被研究,但是在甲壳动物中虽然被证实也是最近研究发现的事,具体作用还需要进一步研究(Wilcockson,2008)。
虽然关于对虾蜕壳调节的主要物质已经为人们所知,但各物质具体功能及其之间交互作用显然比目前机理模式所呈现的复杂。目前为止,关于蜕壳激素含量在蜕壳前期开始降低的推测到也没有被证实(Nakatsuji,2004),相反有证据表明蜕皮前期末蜕皮激素甚至出现了增加(Chung,2005)。
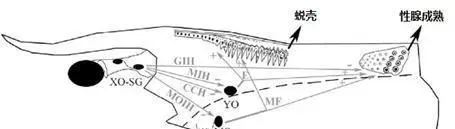
图4对虾蜕壳内分泌调节原理图。
XO-SG:X器官/窦腺复合体;
GIH:性腺抑制激素;
MIH:蜕皮抑制激素;
CHH:甲壳动物糖代谢激素;
MOIH:下颌器官抑制激素;
YO:Y器官;
E:蜕皮激素;
MO:下颌器官;
MF:甲基法尼酯
在对虾养殖过程中,由于蜕壳和和生长繁殖具有很好的相关性,因此养殖户对蜕壳都比较重视。因此,基于多肽类激素GIH/MIH/CCH和蜕皮激素调控蜕壳过程的机理已经被很好的研究,性腺发育和肌肉生长一般是同步进行的,对两者进行调控的关键器官是XO-SG。
在雌性对虾亲本养殖过程中有切除单侧眼柄的习惯,养殖户通过这一操作去除了内分泌激素对蜕壳的抑制。一般情况下,性腺抑制激素和蜕皮抑制激素对机体的抑制作用是相同步的,因此卵巢成熟和早蜕壳是同时出现的,幸存的XO-SG并不能替代已摘除眼柄的功能,因为蜕壳和卵巢的发育速度并不能及时降低。雌性对虾的产卵时间和频率都会增加,这会导致与卵黄形成和蜕壳相关的代谢行为过度旺盛,最终导致卵巢的崩溃(Palasiosetal.,1993;Racottaetal.,2003)。虽然单侧眼柄摘除并不能完全解决对虾增殖中所有问题(Marsdenetal.,2007),针对性腺抑制采取选择性干预措施也不能很好的影响蜕壳和代谢,但是这些措施还是值得尝试。