摘要:运用AQUARESP间歇流水式呼吸仪,研究了在不同浓度氨氮急性胁迫下,卵形鲳鲹呼吸代谢的变化。试验设T0(对照)、T1、T2、T3四个组,各组平均氨氮浓度(TAN)分别为0.08、1.07、1.98、3.07mg/L(非离子氨NH3-N:0.00、0.05、0.09、0.15mg/L)。结果表明:随氨氮浓度升高,卵形鲳鲹耗氧率(MO2)和代谢率(REO)先上升后达到稳定,而血氨(PA)及氧氮比(O:Nratio)则持续上升,T2、T3组的上述指标显著高于对照组(P<0.05);肝糖原(LG)呈下降趋势,从T1组开始就与对照组有显著差异(P<0.05),而排氨率(RN)、氨商(AQ)、蛋白质供能比(PEP)则在氨氮超过1.07mg/L后呈下降趋势,其中T2、T3组显著低于对照组(P<0.05);肝乳酸(LD)无明显变化趋势;相关性回归分析结果表明除LD外,其它呼吸代谢指标与氨氮浓度相关性较高。结论:在本试验所设定的条件下,0.08~3.07mg/L氨氮浓度(NH3-N,0.00~0.15mg/L)没有对卵形鲳鲹产生明显毒性作用,在此氨氮范围内,卵形鲳鲹主要以蛋白质和脂肪供能。随着氨氮浓度升高,卵形鲳鲹的MO2,REO和PA上升,而RN降低,蛋白质供能比例降低,脂肪和糖类上升,增加的糖类能量主要用于大脑和鳃等应对氨氮胁迫的能耗需要。
关键词:卵形鲳鲹;氨氮;耗氧率;排氨率;能源物质;间歇性流水式呼吸仪
1、引言
呼吸和排泄是鱼类新陈代谢活动的重要表征,直接或间接地反映鱼类代谢的水平、活动规律、生理状况、能量需求以及维持最低代谢水平的需氧量等,能体现鱼类与外界环境因子的相互关系。因此研究鱼类的呼吸和排泄,对于了解鱼类代谢生理特点和开展鱼类养殖均有非常重要的意义。在鱼类养殖水体中,氨氮会大量消耗水体溶氧,影响鱼类鳃的氧传递和正常的呼吸代谢,延缓鱼类生长,对鱼体生理活动等造成严重影响甚至导致死亡[1-3]。氨氮在水中有以下平衡:NH3+H3O+⇌NH4++H2O。当水温越高、pH越大,NH3存在比例越大[4]。由于NH3能溶于水,不带电荷,具有较强的脂溶性,几乎能够迅速穿透所有细胞膜;水体pH值和氨氮浓度较高时,NH3会抑制生物的排氨,使血液和组织中NH3浓度升高,导致体内NH3积累而中毒[5-6],造成体内正常代谢减慢或停滞[2,7-8],其急性毒性主要表现在对中心神经元的损害[9]。随着研究的深入,鱼类NH3解毒的途径也逐渐显明。主要有:1.将NH3转化为低毒物质谷氨酰胺和尿素:当鱼体内因氨氮过高产生过多有毒谷氨酸时,脑组织会激活大量谷氨酰胺合成酶将谷氨酸和NH4+转化为无毒的谷氨酰胺保护机体免受损伤[10-11]。2.通过收缩或调整鳃的表面积及皮肤对NH3的通透性,来维持并增加氨的排泄,使体内氨氮水平保持在稳定可耐受状态[12-13]。3.通过减少蛋白质和氨基酸的分解,降低体内氨的产生[14]。4.增加鳃的CO2排泄,酸化鱼鳃周围水体,使水中NH3更多转化为NH4+而加强鱼体内NH3的排泄[15]。5.通过鳃上皮细胞中氯细胞的顶膜与水中的H+或Na+进行交换主动排泄NH4+[16]。
卵形鲳鲹(Trachinotusovatus)属鲈形目(Perciformes)鲹科(Carangidae)鲳鲹属(Trachinotus),俗称金鲳、黄腊鲳等,为暖水性鱼类。近年来,随着人工育苗的成功和养殖技术日趋成熟,卵形鲳鲹已成为海水鱼类养殖的主要品种之一[17],其养殖面积和产量逐年增加,造成的养殖自污染也日益严重,特别是养殖水体的氨氮污染对其产业发展有重要影响。每年夏季我国沿海鱼虾养殖基地由于氨氮污染引起鱼虾大量缺氧死亡造成的损失十分严重[18],池塘养殖中发病池塘的非离子氨浓度高于未发病池塘,是诱发鱼病的主要环境因子之一[19]。目前,关于氨氮对卵形鲳鲹呼吸代谢影响的研究还未见报道,本文研究了不同浓度氨氮急性胁迫对卵形鲳鲹耗氧、排氨及血氨、肝糖原和肝乳酸等指标的影响,为氨氮对卵形鲳鲹的毒理学研究提供基础资料,并为其健康养殖提供科学依据。
2、材料与方法
2.1试验用鱼及养殖系统
试验鱼为广东海洋大学龙海天种苗繁育基地自繁自育的卵形鲳鲹,运回实验室后经消毒处理放入养殖水槽内暂养7d,每天换水1次,换水量为一半。暂养期间,投喂恒兴浮性海水鱼人工配合饲料4号料,每天2次,投喂后及时用虹吸管法清理粪便和残饵。养殖试验在广东海洋大学鱼类种子工程与增养殖实验室的全自动循环水养殖系统进行,水槽规格:75*45*45cm。试验用水以经沙滤及300目网滤的天然海水与曝气3d以上的自来水调配而成,暂养期间水温(21±1.0)℃,盐度18~20,pH值7.9~8.1,DO>5.5mg/L,总氨氮(TAN)<0.09mg/L,NO2-N<0.03mg/L,自然光照。TAN使用TestKits氨氮测试盒(默克公司,原理:水杨酸分光光度法)、NO2-N用萘乙二胺分光光度法测定。
2.2呼吸试验装置
所用测定装置是间歇性流水式呼吸仪(Canada,AQUARESP,下文简称呼吸仪)(图1和图2)。此套系统一个完整的自动测试过程包括测量、水体交换和等待三个阶段。在测量阶段,呼吸测量室完全封闭,测量时间可根据实际需要调节,通常最长以水中溶氧量下降不大于呼吸前溶氧量的10%为基础。测量阶段结束接着水体交换阶段启动,以新水更换呼吸室内旧水。接着是短暂的滞后等待阶段。如此往复,实现长时间实时监测。
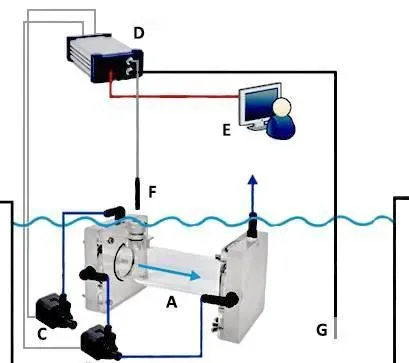
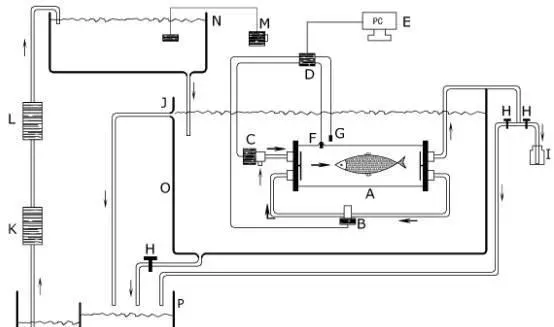
图1呼吸测定原理结构示意图图2AQUARESP呼吸仪原理结构图
A.呼吸室B.循环泵C.冲水泵D.数据采集仪E.计算机F.氧探头G.温度探头H.止水开关I.采水瓶J.溢水口K.紫外灭菌灯L.温控仪M.充气泵N.上位蓄水槽O.实验外环境水槽P.生物滤池Q.抽水泵
2.3呼吸试验方法
试验毒物为NH4CI(分析纯)经105℃烘干至恒重后配制成10g/L的母液,试验时按比例稀释至所需表观测定浓度。经查阅其它鱼类有关的资料[20]和预试验,试验设T0(不添加NH4Cl母液,对照组)、T1、T2、T3共4个组,各组试验期间TAN平均浓度及其它水质参数见表1。试验前停食24h,取暂养健康鱼(平均体重85.87±2.98g,平均体长14.34±0.56cm),随机分到各组下急性胁迫24h,每组3个平行,每个平行10尾鱼。试验水槽体积152L,试验用水体积90L。整个胁迫过程正常充氧,不投饵。为保证各试验组氨氮浓度稳定,每3h用NH4C1母液调节一次浓度,每12h更换曝气充足且氨氮浓度相等的试验用水1次,换水量为100%。胁迫24h后将试验鱼放进养殖条件相同的呼吸室内,稳定适应后进行呼吸测定和水样采集,将鱼放进呼吸室的整个过程不超过3min,且尽量避免使鱼反应过激,凡转移鱼时不慎掉落的鱼一律舍弃。各组均设1个空白(无鱼),每个平行每次均随机取1尾鱼测定,直到取完。耗氧率数据直接由呼吸仪在线测定读取,每尾试验鱼测定6次取平均值,同时采集相应耗氧测定阶段相同次数的水样,现场测定鱼呼吸前后水中TAN含量,取平均值。
呼吸试验结束后立刻取出试验鱼,尾静脉采血并解剖取肝胰脏。血液用1.42mg/mLEDTA·Na2抗凝离心(3000rpm,10min)后取血浆,用于血氨(plasmaammonia,PA)测定。肝胰脏剔除脂肪,用预冷生理盐水冲洗后脱脂棉吸干称重,-80℃冷冻保存,用于测定肝糖原(liverglycogen,LG)与乳酸(lacticacid,LD)。PA、LG、LD分别用血氨A086测试盒、肝糖元A043测试盒、乳酸(LD)A019-2测试盒(南京建成)测定。
2.4计算与数据处理

上述各式中,slope是测定期间水中溶解氧曲线斜率;V是呼吸室、循环泵及流通管的总体积(ml);Vf是鱼体体积(ml);W是鱼体湿重(g);是经鱼体呼吸前后的水体中总氨氮的变化量(mg);△t是测定所用时间(h);OC为氧卡系数(13.56J/mgO2);pKa=0.09018+2729.92/T(T为开氏温度,T=273+T℃)
所得数据均用Excel和SPSS17.0行相关性检验、方差分析,组间差异行Duncan多重比较,数据均用平均值±均值标准误(M±S.E.M.)表示,显著性水平为P<0.05。
3、结果
3.1试验水质参数及卵形鲳鲹中毒症状
各实验组水质参数如表1所示。在24h的胁迫过程中,无试验鱼死亡;T0、T1组的试验鱼未见异常反应,T2、T3组则呈现不同程度呼吸急促反应,体色变浅,体表粘液增多,T3组尤为明显,但未出现极端挣扎、游窜现象。
表1各试验组水质参数
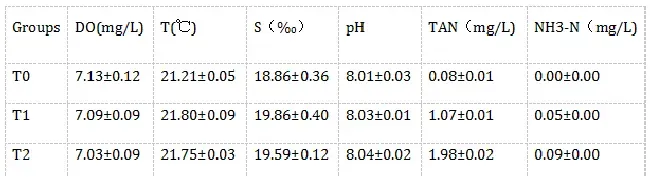
注:所有数据均以M±S.E.M.表示。DO:溶解氧;NH3-N:非离子氨。
3.2不同氨氮水平对卵形鲳鲹呼吸代谢的影响
由表2可知,随氨氮浓度升高,卵形鲳鲹耗氧率(MO2)和代谢率(REO)是先上升而后达到稳定,而血氨(PA)及氧氮比(O:Nratio)则持续上升,T2、T3组的上述指标均显著高于对照组和T1组(P<0.05)。随氨氮浓度升高,肝糖原(LG)呈下降趋势,从T1组开始就与对照组有显著差异(P<0.05),而排氨率(RN)、氨商(AQ)、蛋白质供能比(PEP)则在氨氮浓度超过1.07mg/L后开始呈下降趋势,其中T2、T3组显著低于对照组和T1组(P<0.05)。随氨氮浓度升高,肝乳酸(LD)无明显变化趋势,T1组LD比其他各组都高,但只与T3组有显著性差异(P<0.05);回归相关分析结果也表明LD与氨氮浓度相关性较低。对NH3-N浓度(x)与各项呼吸代谢测定指标进行回归分析,得出回归方程分别如下:MO2=-2.1172x2+0.5176x+0.1607(R2=0.8264),RN=-215.69x2+8.0356x+10.948(R2=0.9355),RE=-27.797x2+6.9451x+2.1757(R2=0.8259),AQ=-1.1865x2-0.2783x+0.1551(R2=0.9004),PEP=-360.14x2-83.155x+46.884(R2=0.8995),O:N=296.62x2+20.828x+12.857(R2=0.9446),LG=341.27x2-184.25x+60.457(R2=0.9639),LD=-5.5671x2+0.6399x+0.2641(R2=0.6653),PA=3758.7x2-55.505x+110.8(R2=0.9994)。
表2不同氨氮水平对卵形鲳鲹呼吸代谢的影响
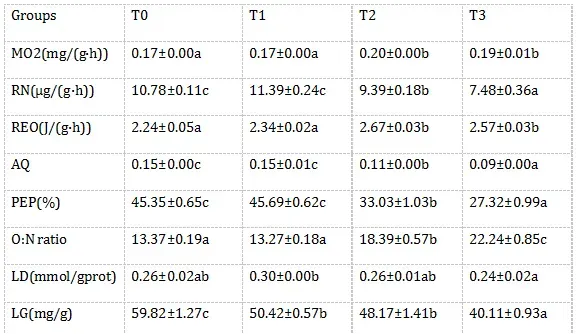
注:所有数据均以M±S.E.M.表示。
3.3体内血氨(PA)累积与MO2、RN、PEP、O:N、LG及LD的关系
图3分别显示了卵形鲳鲹体内血氨(PA)累积与MO2、RN、PEP、O:N、LG及LD之间的关系。由图可见,随着PA不断累积,MO2先升高后在PA为138.31µmol/L(T2)与185.84µmol/L(T3)处达到稳定并显著高于对照组(P<0.05),。RN与PEP则在PA超过115.66µmol/L(T1)后迅速显著下降(P<0.05),而O:N比的变化趋势则刚好相反。LG随PA的累积而迅速降低,一直呈下降趋势;LD在PA为115.66µmol/L(T1)处比其他各组都高,但此后便恢复到对照组水平附近,回归相关分析结果也表明LD与血氨累积相关性较低。经回归相关分析,得出对PA(x)与上述各项呼吸代谢测定指标进行回归分析,得出回归方程如下:MO2=-2E-05x2+0.0056x-0.2381(R2=0.9996),RN=0.0002x2-0.1213x+21.676(R2=0.9515),PEP=0.0047x2-1.6668x+173.33(R2=0.98),O:N=-0.0015x2+0.5681x-31.86(R2=0.987),LG=0.003x2-1.1058x+143.15(R2=0.8388),LD=-1E-06x2-0.0001x+0.3077(R2=0.5105)。
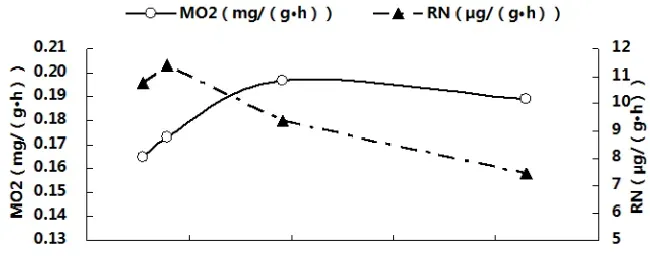
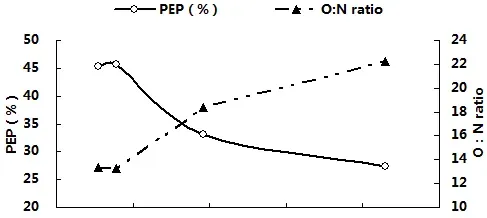
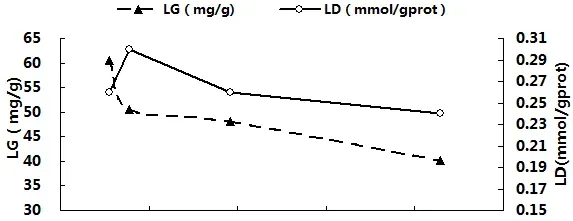
图3卵形鲳鲹体内PA累积与MO2、RN、PEP、O:N、LG及LD的关系
4、讨论
4.1鱼类能量代谢的研究方法
测定鱼类的能量代谢常用间接法,主要有静水式、开放流水式、封闭流水式、间歇流水式四种。静水式无法保证水中溶氧恒稳,易累积代谢废物。开放流水式需要修正数据,很难得到正确的研究数据。封闭流水式可控制入水水质,较常用,但其很难排除鱼体代谢废物在水体中的耗氧,不适于饱食状态下的呼吸测定。间歇流水式测量系统综合了封闭式和开放式的优点,克服了它们测量时间解析度差和不能连续长时间测量的缺点,使得测定更稳定可靠,为众多学者所用[24-26],因此本试验也采用间歇流水式呼吸仪来开展实验。
4.2氨氮对卵形鲳鲹的毒性兴奋效应
在遭受氨氮胁迫时,生物体所作出的呼吸代谢反应因种类、甚至相同种类的不同个体和生长阶段都会有不同程度的差别。如阿部鲻虾虎鱼(Mugilogobiusabei)在2mmol/LTAN下MO2和RN均显著低于对照组,特定生长率却提高了[27]。当在1mmol/L、1.4mmol/L和5mmol/L氨氮中暴露,头3h内,鲤鱼(Cyprinuscarpio)和虹鳟(Oncorhynchusmykiss)的RN都下降,PA上升,但金鱼(Carassiusauratus)却一直维持在对照组水平附近;到12h时,三种鱼类的RN及PA都重新恢复到了对照组水平[12]。在0-10mg/LTAN内,随TAN升高,中国对虾(Penaeuschinensis)MO2、尿素氮排泄率及PA不断增大,RN却不断降低[28]。Racotta认为,MO2等指标随氨氮浓度升高而增大是氨氮在低浓度无毒情况下对机体的刺激现象,是一种“毒物兴奋效应”,当氨氮浓度超过可耐受范围时才会对生物起毒害作用,抑制其各项生理活动[29],如河蚌(Anodontawoodiana)[30]。本试验中,随着氨氮浓度的上升,卵形鲳鲹的MO2和REO不断增大并在氨氮浓度为1.98-3.07mg/L时达到稳定,可见本试验所设定的氨氮浓度使卵形鲳鲹的呼吸代谢产生了毒物兴奋效应。
4.3卵形鲳鲹对氨氮胁迫的适应策略
NH3会抑制生物的氨氮排泄,使PA累积,造成体内正常代谢减慢或停滞[2,5-8]。大量研究表明,PA与环境中氨氮水平成正相关,可用于评估鱼体氨中毒的程度[5][31]。在本研究中,氨氮浓度超过1.07mg/L后,试验鱼RN开始显著降低,PA则显著升高,且氨氮浓度越高,卵形鲳鲹的氨氮排泄受抑制和PA积累越明显。在高氨氮环境下,生物体PA及组织氨含量的升高似乎成了鱼体应对外界氨氮环境的一种适应,因为这会降低鱼体内NH3分压从而减少其后通过鳃和体表流入体内的外源性氨[32]。然而,有些鱼类即使在高氨氮环境下PA也不会变化,如单带红脂鲤(Hoplerythrinusunitaeniatus)[33]、非洲肺鱼(ProtopterusAethiopicus)[34]。可见不同种鱼类即使在相同环境氨压力下,反应也不尽相同,这可能与它们对氨的耐受能力和氨解毒途径有关。有些鱼类会通过减少蛋白质和氨基酸的分解,降低体内氨的产生,从而一方面体现为RN的下降,如虹鳟[14]。本试验中卵形鲳鲹可能也使用了这条解毒途径。
鱼类对氨的一个重要解毒途径是在大脑中将谷氨酸转化为谷氨酰胺,这种转换需要消耗能量,而硬骨鱼类大脑几乎只能利用葡萄糖作为能源物质[35],水体中的氨氮浓度会改变鱼类大脑的能量代谢,引起肝脏LG含量的变化[36]。鱼体排氨的另一个重要途径是鳃的Na+/NH4+离子交换作用,由鳃上皮细胞中的富含线粒体细胞通过各种离子运输体和酶主动运输NH4+离子,且消耗大量能量[6,37]。Chang等研究发现,这些能量源自鱼鳃富含线粒体细胞中储存的糖原,当鱼体遭遇氨氮胁迫时,鳃中糖原用于鳃维持离子分泌机制最初的能量需要,随后由肝脏分解糖原提供其后面的能量需要[38]。在本研究中,卵形鲳鲹LG随氨氮浓度升高而下降,各氨氮处理组LG均显著低于对照组,可见在此氨氮范围下,卵形鲳鲹为了应对外界氨氮的胁迫,加强LG的分解,为大脑和鳃提供能量。
乳酸是衡量机体是否发生厌氧代谢的一个重要指标[36]。当氧供应不足或组织无法足够快处理氧时,机体会通过无氧糖酵解产生大量乳酸[39]。本试验中,各组LD并无显著差异,卵形鲳鲹没有通过增加厌氧代谢来提供能量,这也在一定程度上反应了本试验所设定的氨氮浓度只是对卵形鲳鲹引起兴奋效应,而没有产生明显毒性作用。
AQ可直接反映蛋白质代谢供能占总供能的比例[40]。在硬骨鱼类中,全部以蛋白质氧化供能时,AQ值为0.33;若AQ高于0.33,说明机体内发生了蛋白质的厌氧分解作用,或者代谢底物的分解发生了转换;若低于0.33,表明除蛋白质之外的其它底物参与了氧化分解,蛋白质的供能比例下降[41]。理论上,机体若完全以蛋白质为氧化基质供能,O:N比约为7;以蛋白质和脂肪供能时,O:N比为24;O:N超过24时,主要以脂类和糖类氧化供能,而且O:N越大,脂肪或糖类供能比例也越大,完全以脂肪或糖类供能时,O:N比将无穷大[42-44]。本试验中,氨氮浓度在1.07mg/L以内,卵形鲳鲹AQ、PEP、O:N保持在较稳定水平,PEP约为45%,O:N在13左右,蛋白质是卵形鲳鲹最主要的供能物质。当氨氮浓度超过1.07mg/L后,AQ和PEP均显著低于对照组,O:Nratio则相反,且氨氮浓度越高,这种变化越显著;氨氮为1.98mg/L、3.07mg/L时,AQ分别下降了27.3%、40%,O:N分别增大到18和22,PEP所占比例也进一步从45%下降到33%和27%,脂肪所占供能比例不断增大。可见本试验下,卵形鲳鲹的主要能源物质是蛋白质和脂肪,随着氨氮浓度的增大,其不断调整体内氧化供能物质的比例,降低对蛋白质的利用。这可能是卵形鲳鲹对遭遇外界非离子氨胁迫时的一种适应策略。
5、结论
在本试验所设定的条件下,0.08~3.07mg/LTAN浓度(NH3-N,0.00~0.15mg/L)对卵形鲳鲹产生了兴奋效应而未见明显毒性作用,在此氨氮范围内,卵形鲳鲹主要以蛋白质和脂肪供能。随氨氮浓度升高,卵形鲳鲹的MO2,REO和PA上升,而RN降低,蛋白质供能比例降低,脂肪和糖类上升,增加的糖类能量主要用于大脑和鳃等应对氨氮胁迫的能耗需要。
参考文献
[1]陈坚.环境生物技术[M].北京:中国轻工业出版社,1999,187.
[2]JohnAHARGREAVES,SemraKUCUK.EffectsofDielUn-ionizedAmmoniaFluctuationonJuvenile
HybridStripedBass,ChannelCatfish,andBlueTilapia[J].Aquaculture,2001,195(1):163-181.
[3]夏苏东,李勇,王文琪,等.养殖自污染因子对虾蟹健康的影响及其机理与控制[J].水产科学,2009,28(6):355-360.
[4]KennethEMERSON,RosemarieCRUSSO,RichardELUND,etal.AqueousAmmoniaEquilibriumCalculations:EffectofPhandTemperature[J].JournaloftheFisheriesBoardofCanada,1975,32(12):2379-2383.
[5]GillesLEMARIE,AntoineDOSDAT,DenisCOVèS,etal.EffectofChronicAmmoniaExposureonGrowthofEuropeanSeabass(DicentrarchusLabrax)Juveniles[J].Aquaculture,2004,229(1):479-491.
[6]ShigehisaHIROSE,ToyojiKANEKO,NobukoNAITO,etal.MolecularBiologyofMajorComponentsofChlorideCells[J].ComparativeBiochemistryandPhysiologyPartB:BiochemistryandMolecularBiology,2003,136(4):593-620.
[7]YuenKIP,ShitFCHEW.AmmoniaProduction,Excretion,Toxicity,andDefenseinFish:aReview[J].FrontiersinPhysiology,2010,1:article134,1-20.
[8]DavidAARMSTRONG,DebbieCHIPPENDALE,AllenWKNIGHT,etal.InteractionofIonizedandUn-ionizedAmmoniaonShort-termSurvivalandGrowthofPrawnLarvae,MacrobrachiumRosenbergh[J].TheBiologicalBulletin,1978,154(1):15-31.
[9]DJRANDALL,TKNTSUI.AmmoniaToxicityinFish[J].MarinePollutionBulletin,2002,45(1):17-23.
[10]AJCOOPER,FPLUM.BiochemistryandPhysiologyofBrainAmmonia.[J].PhysiologicalReviews,1987,67(2):440-519.
[11]YKIP,SFCHEW,DJRANDALL.AmmoniaToxicity,Tolerance,andExcretion[J].FishPhysiology,2001,20:109-148.
[12]HonJungLIEW,AmitKumarSINHA,CMicheleNAWATA,etal.DifferentialResponsesinAmmoniaExcretion,SodiumFluxesandGillPermeabilityExplainDifferentSensitivitiestoAcuteHighEnvironmentalAmmoniainThreeFreshwaterTeleosts[J].AquaticToxicology,2013,162:63-67.
[13]PatriciaAWRIGHT,ChrisMWOOD.7ThingsFishKnowaboutAmmoniaandWeDon’t[J].RespiratoryPhysiology&Neurobiology,2012,184(3):231-240.
[14]JonathanMWILSON,KatsuyaIWATA,GeorgeKIWAMA,etal.InhibitionofAmmoniaExcretionandProductioninRainbowTroutDuringSevereAlkalineExposure[J].ComparativeBiochemistryandPhysiologyPartB:BiochemistryandMolecularBiology,1998,121(1):99-109.
[15]DavidJRANDALL,YuenKIP.AmmoniaasaRespiratoryGasinWaterandAir-breathingFishes[J].RespiratoryPhysiology&Neurobiology,2006,154(1):216-225.
[16]JONATHANMWILSON,DAVIDJRANDALL,MARKDONOWITZ,etal.ImmunolocalizationofIon-transportProteinstoBranchialEpitheliumMitochondria-richCellsintheMudskipper(periophthalmodonSchlosseri)[J].JournalofExperimentalBiology,2000,203(15):2297-2310.
[17]黎祖福.南方海水鱼类繁殖与养殖技术[M].北京:海洋出版社,2006,106-114.
[18]赵海涛.氨氮对南方鲶(SilurusmeridionalisChen)幼鱼血液生理、生化及非特异性免疫指标的影响[D].重庆:西南大学,2006.
[19]蒋艾青,杨四秀,郑陶生,等.池塘鱼类暴发性疾病与主要水化因子关系研究[J].水利渔业,2005,25(5):104-105.
[20]LuizaDyF.COSTA,KleberC.MIRANDA-FILHO,MarlonP.SEVERO,etal.ToleranceofJuvenilePompanoTrachinotusMarginatustoAcuteAmmoniaandNitriteExposureatDifferentSalinityLevels[J].Aquaculture,2008,285(1):270-272.
[21]OIFORSBERG.TheImpactofVaryingFeedingRegimesonOxygenConsumptionandExcretionofCarbonDioxideandNitrogeninPost-smoltAtlanticSalmonSalmoSalarL.[J].AquacultureResearch,1997,28(1):29-41.
[22]沈勤,徐善良,严小军,等.温度对花鲈饥饿代谢的影响[J].中国水产科学,2008(3):126-131.
[23]陈宣雄,徐善良,沈庞幼,等.温度对条石鲷幼鱼代谢率、排泄率及窒息点的影响[J].海洋学研究,2012(1):97-103.
[24]MichaelFRISK,JohnFlengSTEFFENSEN,PeterVilhelmSKOV.TheEffectsofTemperatureonSpecificDynamicActionandAmmoniaExcretioninPikeperch(SanderLucioperca)[J].Aquaculture,2013,404-405:65-70.
[25]TommyNORIN,HansMALTE.RepeatabilityofStandardMetabolicRate,ActiveMetabolicRateandAerobicScopeinYoungBrownTroutDuringaPeriodofModerateFoodAvailability[J].TheJournalofExperimentalBiology,2011,214(10):1668-1675.
[26]JohnFlengSTEFFENSEN.MetabolicColdAdaptationofPolarFishBasedonMeasurementsofAerobicOxygenConsumption:FactOrArtefact?Artefact![J].ComparativeBiochemistryandPhysiology-partA:Molecular&IntegrativePhysiology,2002,132(4):789-795.
[27]KIWATA,TSAKAMOTO,IIWATA,etal.HighAmbientAmmoniaPromotesGrowthinaUreogenicGoby,MugilogobiusAbei[J].JournalofComparativePhysiologyB,2005,175(6):395-404.
[28]Jiann-ChuCHEN,Chi-YuanLIN.ResponsesofOxygenConsumption,Ammonia-nExcretionandUrea-nExcretionOfPenaeusChinensisExposedtoAmbientAmmoniaatDifferentSalinityandPhLevels[J].Aquaculture,1995,136(3):243-255.
[29]IlieSRACOTTA,RobertoHERNáNDEZ-HERRERA.MetabolicResponsesoftheWhiteShrimp,PenaeusVannamei,toAmbientAmmonia[J].ComparativeBiochemistryandPhysiology-partA:Molecular&IntegrativePhysiology,2000,125(4):437-443.
[30]葛长字,秦耿,彭小经.氨氮浓度对不同体重河蚌(Anodontawoodiana)耗氧率的影响[J].淡水渔业,2011(2):84-89.
[31]JRUYET,HCHARTOIS,LQUEMENER.ComparativeAcuteAmmoniaToxicityinMarineFishandPlasmaAmmoniaResponse[J].Aquaculture,1995,136(1):181-194.
[32]YuenKIP,WaiLTAM,WaiPWONG,etal.AComparisonoftheEffectsofEnvironmentalAmmoniaExposureontheAsianFreshwaterStingrayHimanturaSigniferandtheAmazonianFreshwaterStingrayPotamotrygonMotoro[J].JournalofExperimentalBiology,2003,206(20):3625-3633.
[33]GMORAES,VLPPOLEZ,GKIWAMA.BiochemicalResponsesofTwoErythrinidaeFishtoEnvironmentalAmmonia[J].BrazilianJournalofBiology,2004,64(1):95-102.
[34]AMLOONG,JYLTAN,WPWONG,etal.DefenseAgainstEnvironmentalAmmoniaToxicityintheAfricanLungfish,ProtopterusAethiopicus:BimodalBreathing,SkinAmmoniaPermeabilityandUreaSynthesis[J].AquaticToxicology,2007,85(1):76-86.
[35]JoséLSOENGAS,ManuelALDEGUNDE.EnergyMetabolismofFishBrain[J].ComparativeBiochemistryandPhysiologyPartB:BiochemistryandMolecularBiology,2002,131(3):271-296.
[36]AmitKumarSINHA,HonJungLIEW,MarjanDIRICX,etal.TheInteractiveEffectsofAmmoniaExposure,NutritionalStatusandExerciseonMetabolicandPhysiologicalResponsesinGoldFish(CarassiusAuratusL.)[J].AquaticToxicology,2012,109:33-46.
[37]DavidHEVANS,PeterMPIERMARINI,KeithPCHOE.TheMultifunctionalFishGill:DominantSiteofGasExchange,Osmoregulation,Acid-baseRegulation,andExcretionofNitrogenousWaste[J].PhysiologicalReviews,2005,85(1):97-177.
[38]JoshuaChia-HsiCHANG,Su-MeiWU,Yung-CheTSENG,etal.RegulationofGlycogenMetabolisminGillsandLiveroftheEuryhalineTilapia(oreochromisMossambicus)DuringAcclimationtoSeawater[J].JournalofExperimentalBiology,2007,210(19):3494-3504.
[39]金一春,曲学伟,尚晓莉,等.温度对白斑狗鱼耗氧率、窒息点及主要生化指标的影响[J].淡水渔业,2010(6):17-23.
[40]CarlosROSAS,GerardCUZON,GabrielaGAXIOLA,etal.AnEnergeticandConceptualModelofthePhysiologicalRoleofDietaryCarbohydratesandSalinityOnLitopenaeusVannameiJuveniles[J].JournalofExperimentalMarineBiologyandEcology,2002,268(1):47-67.
[41]MNKUTTY.AmmoniaQuotientinSockeyeSalmon(oncorhynchusNerka)[J].JournaloftheFisheriesBoardofCanada,1978,35(7):1003-1005.
[42]AnaFARíAS,IkerURIARTE,JorgeHERNáNDEZ,etal.HowSizeRelatestoOxygenConsumption,AmmoniaExcretion,andIngestionRatesinCold(enteroctopusMegalocyathus)andTropical(octopusMaya)OctopusSpecies[J].MarineBiology,2009,156(8):1547-1558.
[43]PMAYZAUD,RJCONOVER.O:NAtomicRatioasaTooltoDescribeZooplanktonMetabolism.[J].MarineEcologyProgressSeries.Oldendorf,1988,45(3):289-302.
[44]TsutomuIKEDA.NutritionalEcologyofMarineZooplankton[J].MemoirsoftheFacultyofFisheriesHokkaidoUniversity,1974,22(1):1-97.
1、来源:南方水产网、南方水产微信公众平台
2、作者:湛江市水产学会
陈刚1,2,3,李金兰1,张健东1,2,3,黄建盛1,2,3,周晖1,2,3,王忠良1,2,3,汤保贵1,2,3
(1.广东海洋大学水产学院,湛江524025;2.广东省水产经济动物病原生物学及流行病学重点实验室,湛江524025;3.广东省普通高校南海水产经济动物增养殖重点实验室,湛江524025)


























