摘要
以花生粕作为鱼粉蛋白替代原料,配制6种等氮等脂的南美白对虾试验饲料,其中花生粕的添加水平分别为0、70、140、210、280和350g/kg。每天投喂三次,养殖6周。结果表明,花生粕的添加水平达到140g/kg以上时,饲料效率和蛋白质效率显著低于基础饲料组(D1)(P<0.05)。花生粕水平增加至210g/kg以上时,对虾的存活率和蛋白酶活性显著低于D1组;全虾水分含量显著增加(P<0.05)。花生粕在饲料中添加水平达到280g/kg或更高时,南美白对虾的增重率显著降低(P<0.05)。血清中过氧化物酶、酸性和碱性磷酸酶随着花生粕添加水平的增加而降低,当添加水平达到280g/kg时显著低于D1组(P<0.05)。花生粕水平达到350g/kg时,对虾的摄食率显著低于D1组(P<0.05)。随着花生粕替代鱼粉比例的增加,干物质、粗蛋白、粗脂肪和灰分的表观消化率逐渐降低,但对南美白对虾肌肉中的黄曲霉毒素含量没有明显影响。结果显示,南美白对虾饲料中花生粕的最大添加量为140g/kg。
1.前言
南美白对虾,学名凡纳滨对虾,其生长快,抗病力强,适应性广,十分适合密集养殖(Williams,Davis&Arnold,1996),在多个国家养殖。南美白对虾已成为中国最主要的养殖虾类,2007年其养殖产量达到106.57万吨(Wu,2008)。鱼粉因其蛋白含量高,氨基酸平衡性好,一直是南美白对虾饲料首选的蛋白原料,目前国内对虾商用饲料中鱼粉的使用量一般在25%~50%(Amaya,Davis&Rouse,2007)。国际国内鱼粉供给偏紧,价格长期居高不下,导致饲料成本持续增加(Davis等,2004)。为了减少南美白对虾养殖对鱼粉的严重依赖,人们将目光转向廉价、来源广的植物性蛋白原料的开发利用(Suarez等,2009;Ye等,2011)。然而,长期以来,国内外对花生粕作为水产蛋白原料利用的相关研究报道较少。
和豆粕相比,花生粕的蛋白质组成中赖氨酸含量偏低,精氨酸含量高些,蛋白品质略低于豆粕(Batal,Dale&Cafe,2005)。花生粕的粗蛋白含量高达40.1%~50.9%,可用于水产饲料中。全球花生的产量每年都在增加,近年来达到了3500万吨。仅中国,花生的产量就为1200万吨,占全球花生总产量的34%。因此,每年可产生350万吨花生粕(Revoredo&Fletcher,2002)。花生粕作为替代蛋白源的研究在禽类和家畜中已有相关报道,在南美白对虾中也有类似的研究报道。(Costa等,2001;Adeola,2009;Lim,1997;Liu等,2008)。为了深入了解南美白对虾利用花生粕的潜力,本文研究了不同花生粕替代鱼粉比例对南美白对虾生长性能、饲料利用、消化酶活性、血液生化指标和虾体黄曲霉毒素B1残留的影响。
2.材料和方法
2.1试验饲料
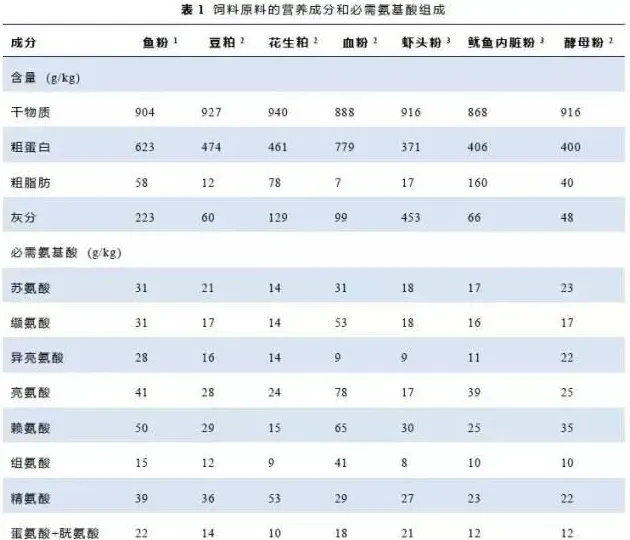
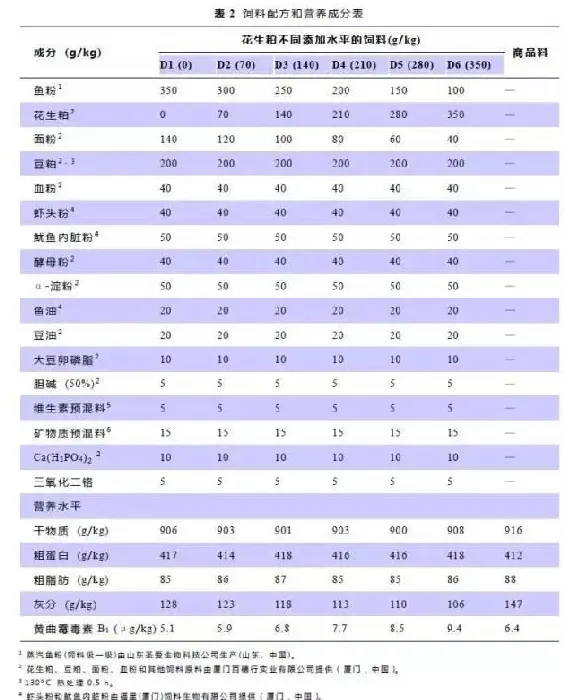
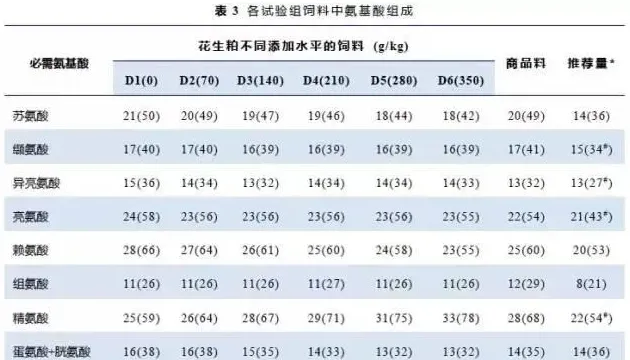
基于市售南美白对虾商品料(RD)和常用的植物性、动物性蛋白源的营养成分和氨基酸组成(表1),配制6种花生粕添加水平的等氮(粗蛋白41%)等脂(粗脂肪8.5%)的试验饲料(D1、D2、D3、D4、D5、D6),在基础饲料(D1)中分别添加0、70、140、210、280和350g/kg花生粕代替鱼粉蛋白。每种试验料中加入0.5%Cr2O3,用于饲料消化率的测定。饲料原料用粉碎机进行粉碎,98%以上过80目筛网,饲料原料按饲料配方配制,混匀,加液体(鱼油、豆油、卵磷脂和水)制成糊状物,再用实验用双螺杆制粒机(CD4XITS)制成1.5mm的硬颗粒饲料,50℃下烘干,于-20℃冰箱保存,备用。试验饲料配方及营养成分见表2,试验饲料必需氨基酸组成见表3。
2.2生长和消化率试验
南美白对虾SPF虾苗购于福建厦门漳浦前亭国家级南美白对虾良种基地,试验虾苗于2个高为0.85米,上部直径为1.22米,下部直径为1.04米的圆形玻璃钢水族箱中(水产养殖封闭循环系统,新奥尔良,洛杉矶,美国)暂养2周。在暂养期间,饲喂商业虾饲料(RD)。试验用虾苗的初始体重为3.37±0.13g(平均值±SD),随机分配到21个150L的循环流水过滤水族箱中,每箱放35尾虾,3箱为一个试验组,共7个试验组,水温维持在27±0.5℃。
每天分别在7:00、13:00和19:00投喂饲料,每次达到表观饱食,投喂1h后回收未食完饲料,并根据剩余饲料量调整投喂量。消化试验结合饲养试验同时进行,饲喂对虾7d后开始收集粪便。为减少粪便中营养的流失,每次在回收未食完饲料1h后用虹吸法只收集包膜完整的新鲜粪便,放入称量瓶中,70℃烘干,直到粪便样品够试验分析为止,粪便样品保存在-20℃冰箱中待分析。为了更精确的评估摄食量,根据Cruz-SuaŁrez等人(2001)所描述的方法并稍加修改测试饲料浸出率,5g颗粒饲料放入80目筛蓝中,浸入海水中连续曝气60分钟。在浸泡期间,每10分钟轻轻搅拌一次饲料。剩余未溶解的饲料进行回收,在70℃下干燥并称重。浸出试验重复3次。
使用多参数光度计(HI83200,哈纳仪器,索基特,RI,USA)测定水质,每天测量水体中溶氧,每周监测盐度、pH值、铵态氮和亚硝酸盐氮两次。在饲养试验期间,这些参数值分别介于6.0~7.5mg/L,26~30g/L,7.8~8.5,0~0.3mg/L和0~0.1mg/L。所有测量的水质指标均在正常范围内。
2.3样品采集
试验结束后,南美白对虾禁食24h后,分别称每箱虾总重,记录虾数。从每箱随机取10尾虾,合并称重,绞碎,于70℃烘箱中烘干,粉碎后全虾样品称重,装入密封袋中于-20℃冰箱中保存,用于常规成分分析。另从每箱随机取10尾虾,用1mL无菌注射器经预冷抗凝剂润湿后,逐尾从心脏采血。采集的血液按箱合并,放入灭菌离心管中混匀,3000r/min4℃下离心20min,收集血清,保存于-80℃冰箱用于分析血液生化参数。采完血后,将虾解剖,取出肝胰腺、胃和肌肉,分别按箱合并,肠腺和胃在-80℃下保存,用于测定消化酶活性;肌肉储存于-20℃,用于测定黄曲霉毒素B1。
2.4生长性能和消化率的计算
按下式计算增重率(WG)、饲料系数(FCR)、蛋白质效率(PER)、摄食率(FR)和成活率(SR)。
WG=100×(Wf-Wi)/Wi
FCR=Wc/(Wf-Wi)
PER=100×(Wf-Wi)/(Wc×P)
FR=100×Wc/[(Wi+Wf)/2]/t
SR=100×Nf/Ni
式中:Wi(g)为平均每尾虾初始体重;
Wf(g)为平均每尾虾终末体重;
Wc(g)为平均每尾虾摄食饲料总量(风干样重);
t(d)为饲喂天数;
P(g)为平均每尾虾摄入蛋白质总量;
Ni为初始虾尾数;
Nf为终末虾尾数。
试验饲料营养成分(干物质、粗蛋白、粗脂肪和灰分)的表观消化率(ADC)计算公式如下(DeSilva&Anderson,1995):
ADC(%)=100+100×(F)/(D)×(DCr)/(FCr)
式中:F为粪便中某营养成分的百分含量,D为饲料中某营养成分的百分含量,DCr为饲料中Cr2O3百分含量,FCr为粪便中Cr2O3百分含量。
2.5化学分析
饲料原料、饲料、粪便样品和虾样品的常规营养成分分析:样品中粗蛋白、粗脂肪、水分和灰分含量根据AOAC1995测定。粗蛋白采用凯氏定氮法(N×6.25);粗脂肪含量测定采用索氏抽提法;水分含量测定采用105℃常压烘箱干燥恒重法;灰分含量测定采用马福炉550℃灼烧法;Cr2O3含量测定采用原子吸收法(美国热电SolaarM6型原子吸收光谱仪);氨基酸含量测定采盐酸水解法,利用日立L-8900氨基酸自动分析仪进行分析。
黄曲霉毒素B1采用酶联免疫吸附试验(Lee,Wang,Allan&Kennedy,2004)。将饲料和肌肉样品磨成粉,玻璃烧瓶中加入5g样品与75mL80%的甲醇溶液(体积/体积)混合,在旋转摇床上120rpm摇15min,溶液静置30分钟后取上清液用于黄曲霉毒素B1的分析。
2.6蛋白酶活力和血液生化指标测定
肝胰腺、胃按质量体积比(W/V,1/10)分别加入pH7.5预冷10mmol/L的Tris-HCl缓冲液,用高速组织匀浆机在冰浴中匀浆,匀浆液以10000r/min,4℃离心20min,取上清液用于测定总蛋白酶活力。蛋白酶活力测定采用Yu等(2008)方法并加以改进。取0.2mL上清酶液与2mL5g/L的酪蛋白、0.1ml40mM/LEDTA-Na2、0.4mL缓冲液、0.8mL蒸馏水37℃孵育15min后,加入1mL30%(V/V)预冷的三氯乙酸以终止显色反应,3000g离心20min,取上清液1mL加入0.55mol/L的碳酸钠溶液5mL,福林试剂1mL于37℃水浴锅中显色15min,在波长680nm处测定其光密度值,同时用标准L-酪氨酸作标准曲线。蛋白酶活性单位定义为:在一定pH和温度(37±1℃)下,1g消化部位鲜活组织内蛋白酶1min水解酪蛋白产生1μg酪氨酸,即为1个蛋白酶活力单位(U)。
2.7血液生化指标测定
血清溶菌酶、超氧化物歧化酶(SOD)、过氧化物酶(POD)和酸性、碱性磷酸酶(ACP、AKP)用南京建成生物工程研究所生产的试剂盒测定,具体操作按照试剂盒说明书要求进行。溶菌酶活以溶壁微球菌(0.2mg/mL)(Sigma,StLouis,MO,USA)(Ellis,1990)冻干粉为底物。溶菌酶活力单位(µg/mL)定义为:37°C时每分钟OD530下降0.001为一个活力单位。超氧化物歧化酶采用黄嘌呤和黄嘌呤氧化酶化学发光法测定,底物与2-(4-碘苯基)-3-(4-硝基酚)-5-苯基氯化四氮唑反应生成红色甲月替染料(McCord & Fridovich,1969)。超氧化物歧化酶酶活单位(U/mL)定义为:在550nm处,抑制NBT光还原相对百分率为50%时的酶量。过氧化物酶采用H2O2减少的方法测定(Brokken,Verbost,Atsma & Wendelaar Bonga,1998),过氧化物酶酶活单位(U/mL)定义:在37℃过氧化氢存在的条件下,每分钟将邻甲氧基苯酚氧化成1μg红棕色的4-邻甲氧基苯酚所需的酶量。ACP和AKP采用Zhao,Liang和Zhang(2010)的方法,即将血清与2%(w/v)硝基苯磷酸盐37℃分别在酸性(pH5.5)或碱性(pH10.1)缓冲液中孵育30min,测定520nm处的吸光值,酶活单位(U/100mL)定义为:在37°C反应30min每100mL血清产生1mg硝基酚酯所需的酶量。
2.8数据分析
所有实验数据均以平均值±标准差(Mean±SD)表示,用SPSS13.0进行单因素方差分析(ANOVA)差异的显著性,并进行Student-Neuman-Keuls多重比较。增重率、饲料系数、蛋白质效率、摄食率、存活率、全鱼组成和消化率数据用百分比或比率表示,并在统计分析前进行反正弦变换。不同组间的差异显著性用P<0.05表示。
3结果
3.1生长指标
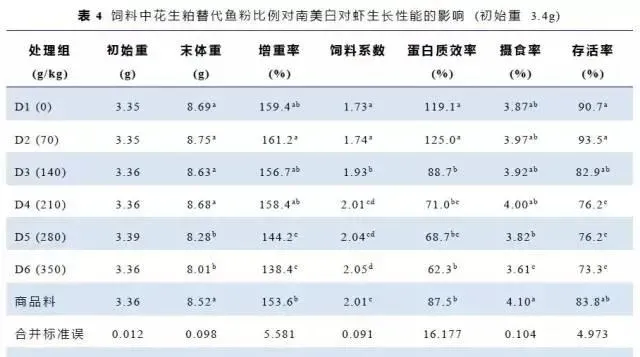
饲料中花生粕替代鱼粉比例对南美白对虾生长性能的影响结果见表4。随着饲料中花生粕添加水平的增加,增重率、蛋白质效率、摄食率和虾存活率均降低,当添加水平为280~350g/kg时,白虾的增重率较对照组显著降低,添加水平为70g/kg组白虾的蛋白质效率与对照组相近,但是显著高于140~350g/kg组和参考饲料组。添加水平为70~280g/kg时,白虾摄食率与对照组相近,添加水平为350g/kg摄食率最低。添加水平为70~140g/kg时,白虾的存活率与对照组和商品饲料组没有差异,但是比其他处理组高。饲料系数随饲料中花生粕添加比例的增加而逐渐升高,当添加水平增至140~350g/kg时,饲料系数显著增加。当白虾饲料中花生粕添加水平为0和70g/kg时与商品饲料组相比,饲料系数更低,蛋白质效率更高。
3.2南美白对虾体成分及肌肉中黄曲霉毒素B1残留水平
饲料中添加不同水平的花生粕对南美白对虾体成分及饲料中黄曲霉毒素B1在肌肉中残留的影响见表5。随着花生粕添加水平的增加,虾体粗蛋白和灰分含量逐渐降低,虾体水分逐渐增加。当花生粕添加水平增至280~350g/kg时,与0添加水平相比,虾体粗蛋白含量显著降低,虾体水分含量则显著增加。与0添加水平相比,350g/kg组虾体粗灰分含量显著降低。各组间虾体粗脂肪含量和肌肉中黄曲霉素B1水平差异不显著。
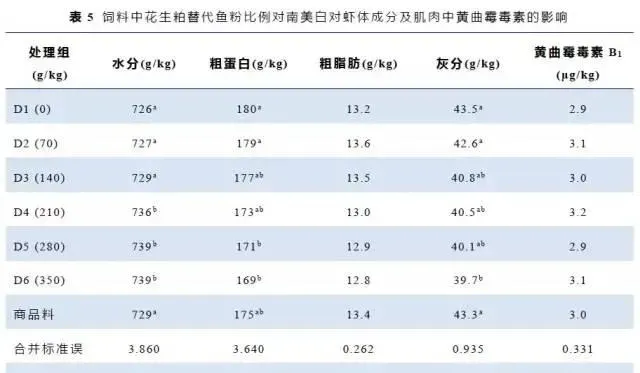
3.3表观消化率
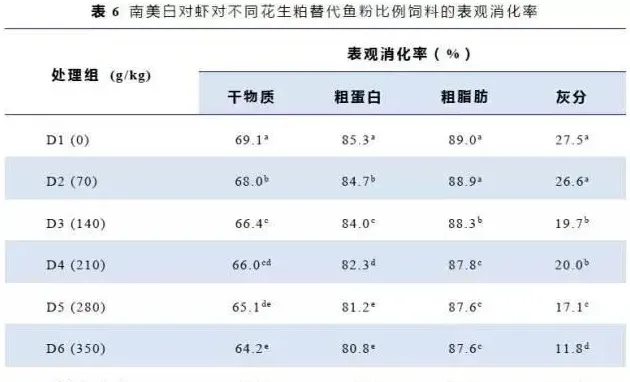
南美白对虾对饲料干物质、粗蛋白、粗脂肪和灰分的表观消化率结果见表6。随着花生粕替代鱼粉蛋白比例的增加,干物质、粗蛋白、粗脂肪和灰分的表观消化率逐渐降低。各试验组的干物质和粗蛋白的表观消化率显著低于对照组;花生粕添加水平在140~350g/kg时,各组粗脂肪和灰分的表观消化率显著低于0和70g/kg组。
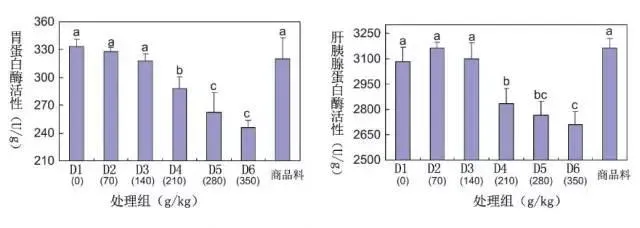
3.4蛋白酶活力
结果见图1。各试验组的肝胰腺和胃蛋白酶活性均低于对照组,当花生粕添加水平为70~140g/kg时,肝胰腺和胃蛋白酶活与基础饲料组和商品饲料组相近,当添加水平为210~350g/kg时,肝胰腺和胃蛋白酶活性显著降低。
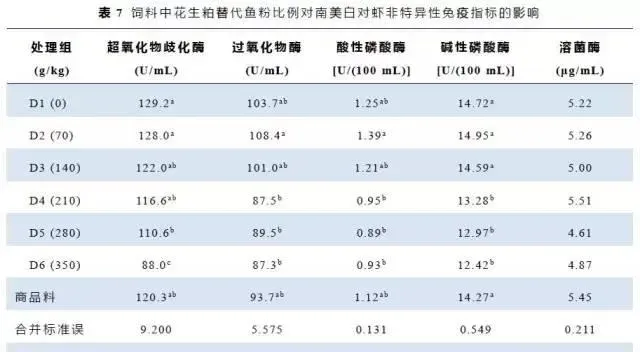
3.5血液指标
血液中超氧化物歧化酶(SOD)、过氧化物酶(POD)、酸性磷酸酶(ACP)和碱性磷酸酶(AKP)酶活变化趋势与增重率和蛋白质效率相似,见表7。除超氧化物歧化酶外,当花生粕添加水平为210~350g/kg时,白虾血液参数较对照组显著降低。各处理组白虾血液中溶菌酶活性差异不显著。
4讨论
本研究在实验室条件下探讨了实用配方添加花生粕的可行性。本试验结果表明随着花生粕添加水平的增加,增重率、饲料效率、蛋白效率和白虾的存活率呈下降趋势,此外,不同花生粕添加水平组的生长性能也不同。对白虾增重率、饲料效率、蛋白效率和虾存活率无负作用的花生粕添加水平上限值分别为210、70、70和140g/kg。Lim(1997)和Liu等(2008)研究表明,在饲料中添加较低水平的花生粕(104~120g/kg)对白虾的生长性能无不良影响。这些结果表明白虾对花生粕替代鱼粉的比例是有限的。
随着花生粕替代鱼粉蛋白比例的增加,南美白对虾的胃蛋白酶活性逐渐降低,肝胰蛋白酶活性先增高后降低,并且营养物质消化率也随花生粕替代鱼粉比例增加而降低(Klein,Cohn&Alpers,1998),提示大幅度增加花生粕替代鱼粉比例会降低南美白对虾消化力,影响营养物质消化,进而影响南美白对虾的生长性能。与花生粕相似,在鱼饲料中添加过高的豆粕也会降低消化酶活性(Bureau,Harris&Cho1998;Krogdahl等,2003;Krogdahl&Bakke-McKellep,2005)。花生粕明显影响了营养消化率,对于干物质和粗蛋白的表观消化率的负面影响大于粗脂肪和灰分。鱼饲料中添加高水平的植物蛋白也有相似的结果(Opstvedta等,2003;Tomás等,2005)。因此,营养物质表观消化率的降低,特别是蛋白质,是造成白虾饲喂花生粕后生长性能下降最有可能的主要原因。另外,花生粕大量添加时,饲料中蛋氨酸+胱氨酸和苯丙氨酸+酪氨酸含量降低,破坏了饲料中氨基酸平衡性,降低了白虾的生长性能和饲料利用率。
尽管各试验组饲料的粗蛋白水平相近,但是各组的白虾蛋白质效率却明显不同,结果表明花生粕影响饲料中蛋白的利用率,低品质的饲料蛋白会降低蛋白利用率(Day&Plascencia-GonzaŁlez,2000),由此可能导致鱼体内蛋白质的降解。在虹鳟的研究中既证实了这一现象。虹鳟饲喂低品质蛋白的饲料会导致体内蛋白质的降解。(Martin等,2003)。由于赖氨酸和精氨酸在消化、吸收过程中能产生拮抗(Kim,Kayes&Amundson,1992;Berge,Bakke-McKellep&Lied,1999),精氨酸的增加会降低赖氨酸的消化率(Fournier等,2003)。因此蛋白饲料的生物效能可能部分依赖于赖氨酸和精氨酸在消化吸收中相互拮抗的作用。(Goytortua-Bores等,2006)。在本研究中,当饲料中花生粕添加量为140~350g/kg时,饲料中精氨酸的含量比对照组高13.6~32.2%。因此我们认为饲喂花生粕饲料时可能会出现赖氨酸和精氨酸的拮抗作用,从而影响了赖氨酸的吸收利用。因此我们推测,花生粕大量添加时,过高的精氨酸含量降低了南美白对虾对蛋白的利用率。
在某些情况下,饲料中高含量的植物蛋白成分可降低水产动物的适口性(Lim&Dominy,1990)。在本研究中,花生粕添加过量,当添加水平达到280g/kg时降低了白虾的摄食率。精氨酸和诱食剂可以增强鱼类和甲壳动物的食欲(Borquez&Cerqueira,1998;Goytortua-Bores等,2006),尽管花生粕添加量为350g/kg时,精氨酸含量很高,但在饲料中添加诱食剂也无法逆转该组摄食率下降的结果。
本研究发现,当白虾饲料中花生粕含量达到280g/kg或更高时,将降低对虾的体蛋白和体灰分的沉积,而体水分含量增加,综合前人的研究提示,体水分沉积的增加可能导致了体蛋白和体灰分的消耗(Lim,1997)。体蛋白和体灰分沉积降低的原因有可能是南美白对虾消化力下降影响了营养物质的消化吸收,然而对虾体脂肪沉积没有受影响的机制仍不清楚。
本研究结果发现,除溶菌酶外,饲料中用花生粕替代鱼粉蛋白明显降低血清超氧化物歧化酶(SOD)、过氧化物酶(POD)和酸性、碱性磷酸酶(ACP、AKP)活性,且花生粕添加比例愈大,降低作用愈明显,特别是当添加水平高于210g/kg时,饲料中添加高水平的花生粕可能会使对虾营养不良和处于高度物理应激状态,进一步表现为降低生长性能。在用其它植物蛋白源替代鱼粉时,鱼、虾也出现类似现象(Rumsey等,1994;Burrells等,1999;Krogdahl等,2003;Tibaldi等,2006),这可能与植物蛋白原料大比例替代鱼粉导致水产动物营养不良有关。本研究发现,饲料中添加不同水平的花生粕对血清中的溶菌酶活性无影响,与Sitja-Bobadilla等(2005)的研究一致,豆粕对吉富罗非鱼(Sparusaurata)的溶菌酶活性也没有影响。
由于花生粕易感染黄曲霉菌,限制了其在配合饲料中的应用。本研究测定了花生粕替代饲料中黄曲霉毒素含量以及虾肌肉中黄曲霉毒素残留量,发现饲料中黄曲霉毒素的含量随着花生粕添加比例的增加而增加,但是试验组饲料中最高的黄曲霉毒素含量也低于10µg/kg,最高值也在欧盟、日本、加拿大、澳大利亚、美国等多个国家的人类食品安全限制的范围内(5~20µg/kg)(FAO2004)。虾肌肉中的黄曲霉毒素不受饲料中黄曲霉毒素含量的影响,在饲喂6周后仍保持在较低水平(低于5µg/kg),说明黄曲霉毒素在虾肌肉中的残留量相对较低。Boonyaratpalin等(2001)也观察到类似现象,在饲喂4~6周后斑节对虾肌肉中的黄曲霉毒素残留量与饲料中的含量没有相关性。Deng等(2010)研究发现在罗非鱼饲料中添加不同剂量的黄曲霉毒素饲喂20周后,仅在肝胰脏中有残留,而不是在肌肉中。这些结果表明黄曲霉毒素在鱼、虾体内的消除可能存在时间效应关系,需要进一步的研究来证实。
5小结
饲料中花生粕较大比例替代鱼粉时,南美白对虾的生长性能、饲料效率、营养物质消化率以及抗生理应激能力明显降低。饲料中高水平添加花生粕对对虾的不良反应可能是由于饲料中缺少某些必需氨基酸和营养物质消化率低而造成。在本试验条件下,南美白对虾饲料中花生粕的最大用量为140g/kg。此剂量的花生粕在饲喂白虾6周后,肌肉中黄曲霉毒素B1含量仍然很低,在饲料中应用能够满足食品安全的需求。(完)
(原文:Xiang-heLiu,Ji-danYe,KunWang,Jiang-hongKong,WeiYang&LeiZhou.PartialreplacementoffishmealwithpeanutmealinpracticaldietsforthePacificwhiteshrimp,Litopenaeusvannamei[J].AquacultureResearch,2012,43,745–755)
1、来源:《中大水生通讯》第52期
2、作者:广州市诚一水产科技有限公司郭定乾/译
3、广州市诚一水产科技有限公司微信号:gzchengyi2013


























